Nessun prodotto nel carrello.
Menu
Usa le tue credenziali per accedere
Compila il form sottostante per creare il tuo account
"*" indica i campi obbligatori
Registrati
La titolazione è una tecnica di analisi molto diffusa in chimica analitica, utile per determinare con precisione la quantità o concentrazione di una sostanza.
È particolarmente importante in tutti quei processi industriali, di produzione e di trasformazione, dove è cruciale conoscere con esattezza la concentrazione di una specie chimica, in quanto questa contribuisce sensibilmente alla qualità del prodotto finito o all’efficienza di un processo.


La titolazione chimica è una tecnica di misurazione quantitativa: la concentrazione di un analita in soluzione è determinata a seguito del completamento della reazione tra la sostanza da misurare e un reattivo. Questo reagente, denominato titolante, è una soluzione di concentrazione nota che viene aggiunta alla soluzione contenente la specie da misurare (analita). L'aggiunta avviene gradualmente e ciò permette di determinare il punto in cui si verifica la reazione completa tra titolante e analita. Questo punto critico è indicato dall'uso di un indicatore, una sostanza che cambia colore in modo evidente al raggiungimento dell'equivalente chimico. Il punto in cui la reazione è completa e sono presenti quantità equivalenti di titolante e analita (in rapporto stechiometrico equivalente) è chiamato punto di equivalenza.


Le titolazioni si basano su reazioni chimiche che devono soddisfare quattro requisiti:


La titolazione chimica è una procedura analitica impiegata per determinare la concentrazione di un’ampia gamma di diverse sostanze. Esiste una nutrita libreria di metodi che da molti anni vengono utilizzati con successo in ambito chimico. Una delle tipologie di titolazione più diffuse è sicuramente la titolazione acido-base. Poiché lo scopo principale della titolazione è fornire valori accurati della concentrazione di una sostanza, è oggi consigliabile ricorrere alla Titolazione Automatica, che è da preferire a quella manuale per una serie di motivi: annullamento dell’errore dovuto alla soggettività nella rilevazione del punto di fine, migliore ripetibilità di analisi, maggiore sicurezza degli operatori, dosaggi più precisi e quindi migliore accuratezza.
L'utilizzo della titolazione chimica riveste un ruolo importante nel campo chimico, poiché fornisce una metodologia accurata e affidabile per la determinazione delle concentrazioni di sostanze chimiche. Questa tecnica è fondamentale per il controllo di qualità in molte industrie, come quella farmaceutica, e alimentare. La titolazione chimica offre inoltre la possibilità di analizzare una vasta gamma di campioni diversi, contribuendo così alla comprensione delle proprietà chimiche di sostanze e miscele.
Per eseguire con successo una titolazione chimica, è essenziale disporre dei giusti strumenti e sostanze. Innanzitutto, è necessario avere una soluzione titolante, che è una soluzione di concentrazione nota, preparata con cura per garantire accuratezza nei risultati. Un'altra componente chiave è l'indicatore, una sostanza chimica che cambia colore quando la reazione di titolazione raggiunge il punto di equivalenza. Questo cambiamento di colore fornisce un segnale visivo chiaro per identificare il completamento della reazione. Nella titolazione automatica al posto dell’indicatore visivo viene utilizzata una sonda per la rilevazione del punto di fine. L'attrezzatura necessaria per effettuare una titolazione automatica prevede quindi:


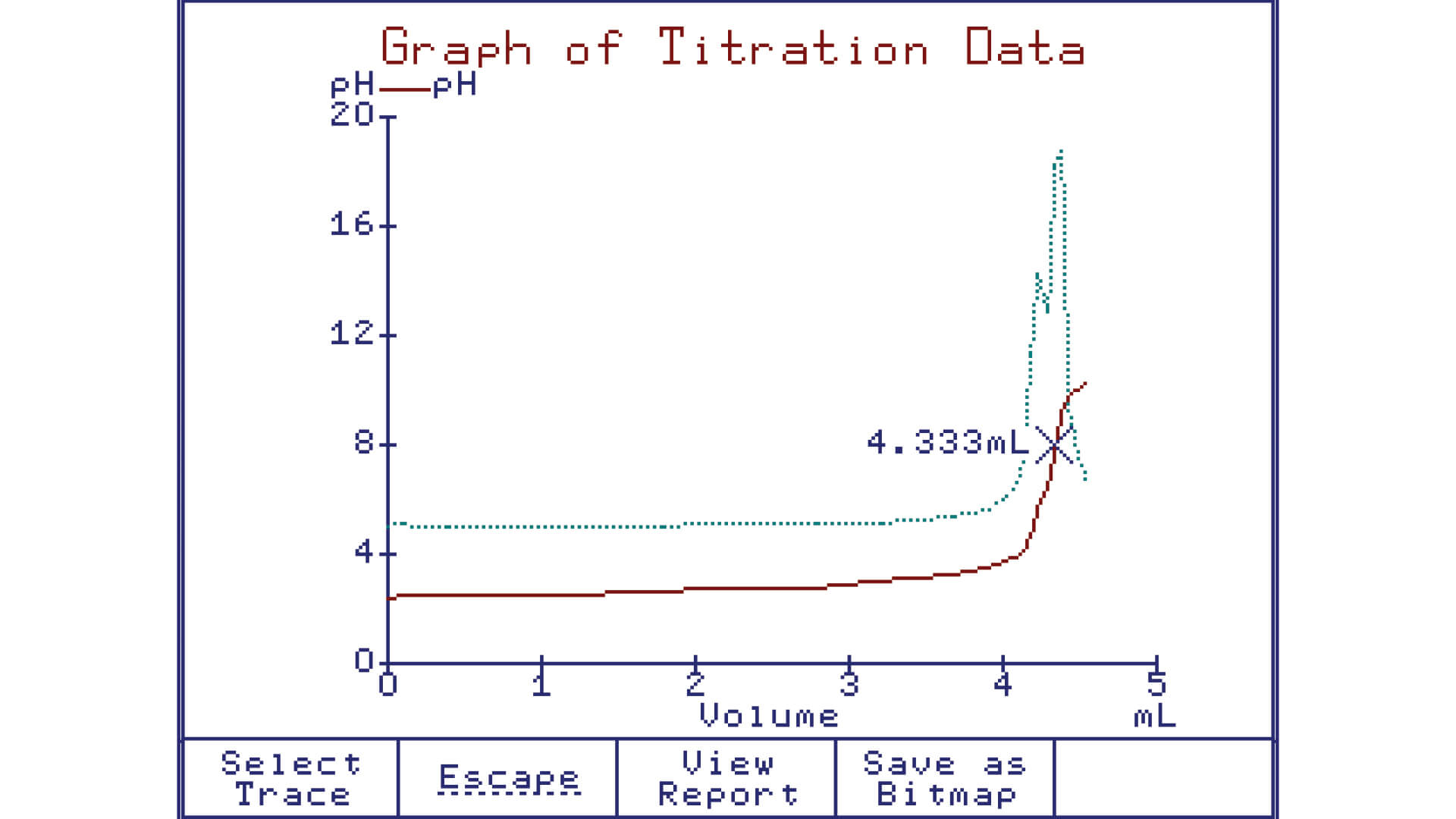
La procedura di una titolazione chimica segue un processo sistematico. Inizialmente, la soluzione campione di concentrazione sconosciuta viene misurata accuratamente e posta in un contenitore appropriato. Si aggiunge quindi l'indicatore, che modificherà il suo colore al raggiungimento del punto di equivalenza. La soluzione titolante, contenente una sostanza reattiva di concentrazione nota, viene successivamente aggiunta goccia a goccia alla soluzione campione sotto agitazione costante. Durante l'aggiunta della soluzione titolante, si osserverà un cambiamento graduale nel colore del sistema. Una volta raggiunto il punto di equivalenza, il cambiamento di colore sarà improvviso e ben evidente. Questo segnalerà la conclusione della reazione e indicherà che la quantità di soluzione titolante aggiunta è sufficiente per completare la reazione chimica.


Il calcolo delle quantità e delle concentrazioni delle sostanze coinvolte nella titolazione si basa sulla conoscenza della reazione chimica bilanciata e sulla misurazione dei volumi delle soluzioni utilizzate. La relazione stechiometrica tra la soluzione titolante e la soluzione campione consente di determinare la proporzione tra le loro concentrazioni. Utilizzando questa proporzione e considerando il volume della soluzione titolante aggiunto per raggiungere il punto di equivalenza, è possibile calcolare con precisione la concentrazione della soluzione campione. Questo calcolo si basa sulla formula:
C campione X V campione = C titolante X V titolante
dove C rappresenta la concentrazione e V il volume. Questo calcolo permette di ottenere la concentrazione desiderata della soluzione campione, contribuendo così alla determinazione accurata delle concentrazioni delle sostanze coinvolte nella titolazione chimica.
La titolazione chimica svolge un ruolo insostituibile sia nell'analisi qualitativa che in quella quantitativa delle sostanze chimiche. Nell'ambito dell'analisi qualitativa, la titolazione chimica offre un metodo affidabile per identificare la presenza di specifici composti chimici in una soluzione campione. L'uso di indicatori, i quali cambiano colore al raggiungimento del punto di equivalenza, permette di rilevare con precisione la comparsa di una reazione chimica. Dall'altro lato, nell'analisi quantitativa, la titolazione chimica consente di determinare con precisione le concentrazioni esatte di sostanze presenti nelle soluzioni campione. Utilizzando la relazione stechiometrica tra le reazioni chimiche coinvolte, è possibile calcolare in modo accurato la quantità di una sostanza sconosciuta o nota presente nella soluzione. Questa versatilità rende la titolazione chimica uno strumento fondamentale per soddisfare le esigenze di analisi sia qualitativa che quantitativa nei settori scientifici e industriali.
La titolazione chimica risulta un potente strumento tanto nell'industria quanto nella ricerca scientifica. Nel contesto industriale, la titolazione chimica è un alleato cruciale nella verifica della qualità dei prodotti. Attraverso l'accurata misurazione delle concentrazioni chimiche, l'industria può garantire la consistenza e l'integrità dei suoi prodotti, soddisfacendo le aspettative dei clienti e le normative di settore. La titolazione trova applicazione in diversi settori industriali, dall'agroalimentare alla produzione di materiali, contribuendo a garantire che i prodotti finiti rispettino gli standard di sicurezza e performance. Nella ricerca scientifica, la titolazione chimica si erige come uno strumento fondamentale per esplorare la complessità del mondo molecolare. Consentendo la determinazione accurata delle concentrazioni di sostanze chimiche, la titolazione supporta studi dettagliati sulle reazioni chimiche, la cinetica e la termodinamica. Gli scienziati possono valutare nuove metodologie, investigare interazioni chimiche e avanzare nella comprensione delle proprietà delle sostanze. Questo metodo offre anche un contributo significativo alla caratterizzazione di campioni sconosciuti o complessi, offrendo una chiave per decifrare strutture chimiche e identificare composti chimici.
La titolazione chimica riveste un ruolo fondamentale nella regolamentazione delle sostanze chimiche, in quanto fornisce dati critici per la valutazione della sicurezza e della conformità alle normative. Le agenzie regolatorie utilizzano la titolazione chimica per determinare con precisione le concentrazioni di sostanze chimiche nei prodotti e nell'ambiente. Questa analisi contribuisce alla definizione di limiti di concentrazione consentiti per sostanze tossiche o pericolose, garantendo la tutela della salute umana e dell'ambiente. Inoltre, la titolazione chimica viene impiegata per verificare la conformità dei prodotti alle specifiche regolamentari, garantendo la qualità e l'affidabilità delle merci messe sul mercato. In questo contesto, la titolazione chimica si rivela essere uno strumento essenziale nella creazione e nell'applicazione di leggi e regolamenti finalizzati alla gestione sicura e responsabile delle sostanze chimiche.
Con un titolatore automatico potenziometrico è possibile eseguire una gran varietà di titolazioni
La titolazione acido base è tra le titolazioni più frequenti e prevede una reazione fra un acido e una base in un mezzo acquoso o non acquoso. È utilizzata ad esempio per la determinazione dell’alcalinità dell’acqua, dell’acidità del vino e di altri prodotti alimentari come succhi di frutta, latte e aceto.
Si basa sulla reazione tra una specie ossidante e una riducente. Durante la titolazione lo ione ossidante (che può essere l’analita o il titolante) si riduce (ovvero acquista elettroni) mentre lo ione riducente si ossida perdendo uno o più elettroni. Trova applicazione ad esempio nel settore alimentare per la determinazione della solforosa libera e totale nel vino e la misura della vitamina C (acido ascorbico), nell’ambito chimico e nell'industria galvanica, ad esempio nella determinazione del ferro in soluzioni acide.
Si utilizza per la determinazione di cationi come calcio, rame e zinco. Ovvero tutte quelle specie chimiche in grado di complessare molecole come EDTA (acido etilendiamminotetracetico) in funzione del pH della soluzione. Trova applicazione soprattutto nel settore dell’industria chimica e nel settore ambientale. Per questo tipo di titolazioni è necessario abbinare un elettrodo ione selettivo (ISE) specifico per la molecola d’interesse.
Si utilizzano per la titolazione di specie chimiche in grado di generare in soluzione la formazione di un precipitato (in alcuni casi torbido, in altri anche colorato). A mano a mano che il titolante è dosato, si verifica la formazione di un precipitato insolubile. Quando il titolante si complessa a tutto l’analita presente ed inizia ad essere aggiunto in eccesso si determina la formazione di un complesso ad indicare la fine della titolazione. Un esempio di titolazione di precipitazione è la determinazione dei cloruri nelle acque e negli alimenti o l’argento nei metalli preziosi. Anche per queste titolazioni, solitamente si abbina un elettrodo ione selettivo.
Le titolazioni argentometriche sono una sottofamiglia delle titolazioni di precipitazione in quanto sfruttano la non solubilità dei sali di argento. Questi sali si formano quando come titolante si utilizza il nitrato d’argento. Una delle titolazioni più conosciute è quella della determinazione dei cloruri e del cloruro di sodio che utilizza un elettrodo ISE argento/solfuri.
Si utilizza quando l’analita ha scarsa solubilità in acqua. È possibile titolare sostanze chimiche con caratteristiche di acidi o basi molto deboli, sono effettuate in solventi non acquosi abbinando degli elettrodi di pH specifici per solventi. Un esempio di titolazione non acquosa è la misura degli isocianati nelle plastiche.
Con i titolatori automatici Hanna è inoltre possibile effettuare misure dirette di pH, potenziale redox e misure dirette di ioni specifici mediante elettrodi ione selettivi (ISE).
Altre tipologie di titolazioni sono quelle Karl Fischer per la misura del contenuto d’acqua in diversi campioni, soprattutto solventi non acquosi. Ovvero delle titolazioni il cui punto di fine è determinato per via amperometrica. Queste tipologie di titolatori includono: