Nessun prodotto nel carrello.
Menu
Usa le tue credenziali per accedere
Compila il form sottostante per creare il tuo account
"*" indica i campi obbligatori
Registrati
Il termine "pH" fu introdotto nel 1909 dal chimico danese Søren Sørensen. Ad oggi il pH è definito come una scala di misura utilizzata per esprimere il carattere acido o basico delle soluzioni:
Nell'acqua sono presenti ioni di idrogeno (H+) e ioni ossidrili (OH-), derivanti dalla rottura della molecola dell'acqua (H2O):


Il valore di pH può essere determinato per via elettrica, sfruttando il potenziale creato dalla differenza di concentrazione di ioni idrogeno su due lati di una membrana di vetro, facendo ricorso ad uno strumento elettronico, detto pHmetro o piaccametro ovvero misuratore di pH (più raramente chiamato anche piaccometro).
L’analisi del pH può essere eseguita anche per via chimica, sfruttando la capacità di alcune sostanze, dette indicatori, di modificare il loro colore al variare del pH della soluzione.


Con il metodo chimico si può misurare il pH mediante 3 metodologie:
1) Cartine tornasole, ovvero degli indicatori su strisce di carta, che cambiano colore quando vengono immerse in sostanze acide o basiche.
2) Test kit chimici, metodo con il quale si utilizza un reagente che, entrando in contatto con una soluzione acquosa, cambia colore a seconda della concentrazione di ioni idrogeno (pH), in un dato intervallo. Come per le cartine al tornasole, per determinare il valore di pH, si confronta il colore del campione reagito con la scala di colore corrispondente.
3) Colorimetri digitali (o fotometri): utilizzano lo stesso principio dei test kit chimici, ma la lettura avviene elettronicamente, attraverso la misura dell'assorbanza di una soluzione colorata.
L’utilizzo di un pHmetro è oggi universalmente considerato il modo migliore per la misura di pH, perché presenta molti vantaggi rispetto ai metodi chimici. Si elencano di seguito alcuni vantaggi del pHmetro:
I test kit chimici e le cartine al tornasole sono dotati di precisione e risoluzione limitate rispetto al pHmetro, poiché si basano sulla distinzione di differenze di colore percepite dall'occhio umano. Il colorimetro digitale elimina l’incertezza tipica dei test kit chimici e delle cartine al tornasole, ma rispetto al pHmetro lavora su una scala solitamente ridotta e richiede più tempo per la procedura di analisi.


Il sistema più comune di misurazione del pH è costituito da tre elementi:
La risposta in mV di un elettrodo pH segue l’equazione di Nernst:
Eobs = EC + In(10)(RT / nF)(log[aH+])
Eobs = Potenziale osservato
EC = Potenziale di riferimento inclusi altri potenziali stabili e fissi
aH+ = Attività ione idrogeno
T = Temperatura in gradi Kelvin (C° + 273.15)
n = Numero di valenza dello ione misurato
F = Costante di Faraday (9.6485 x 104)
R = Costante dei gas (8.31432J / KMol)
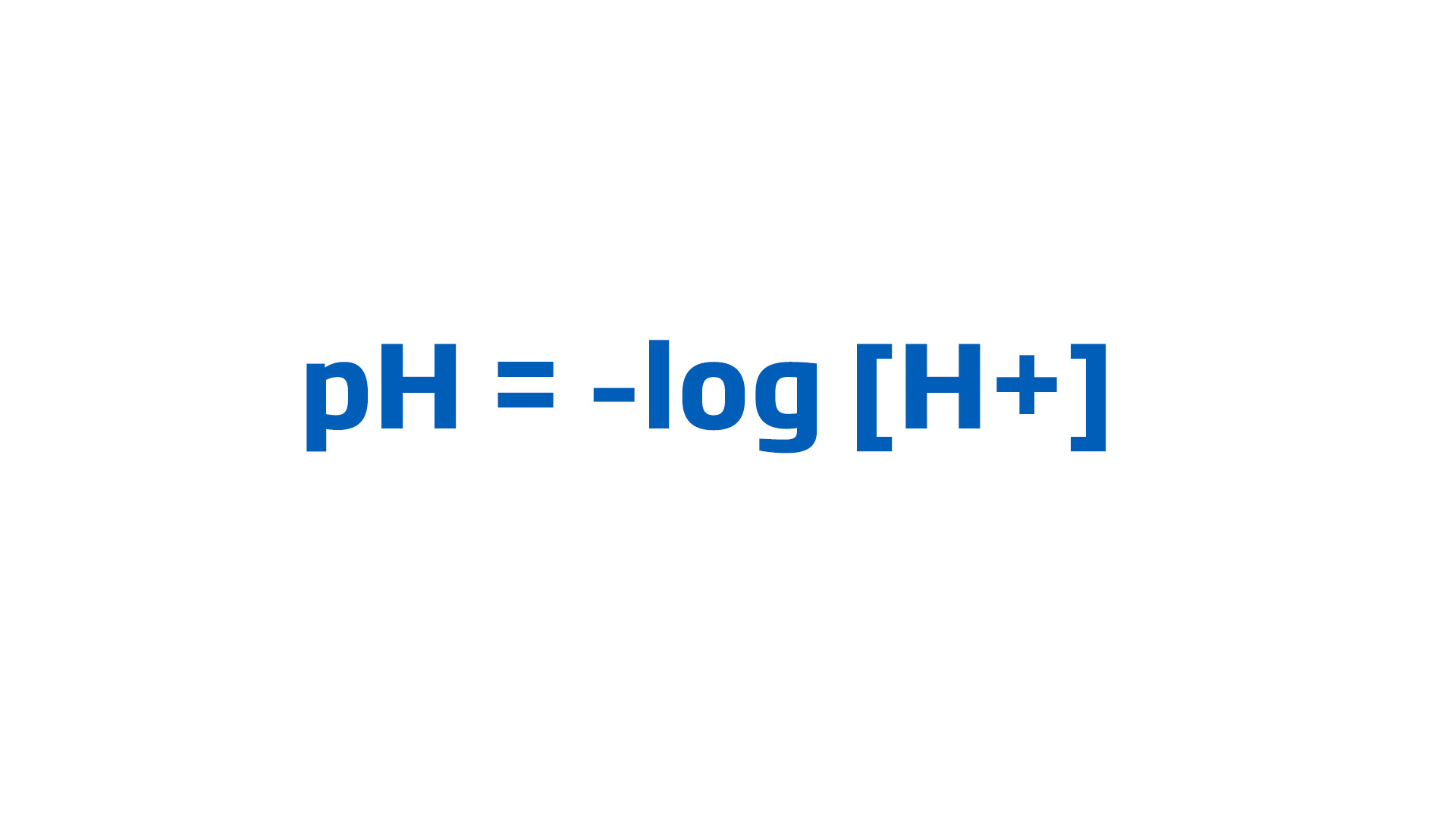
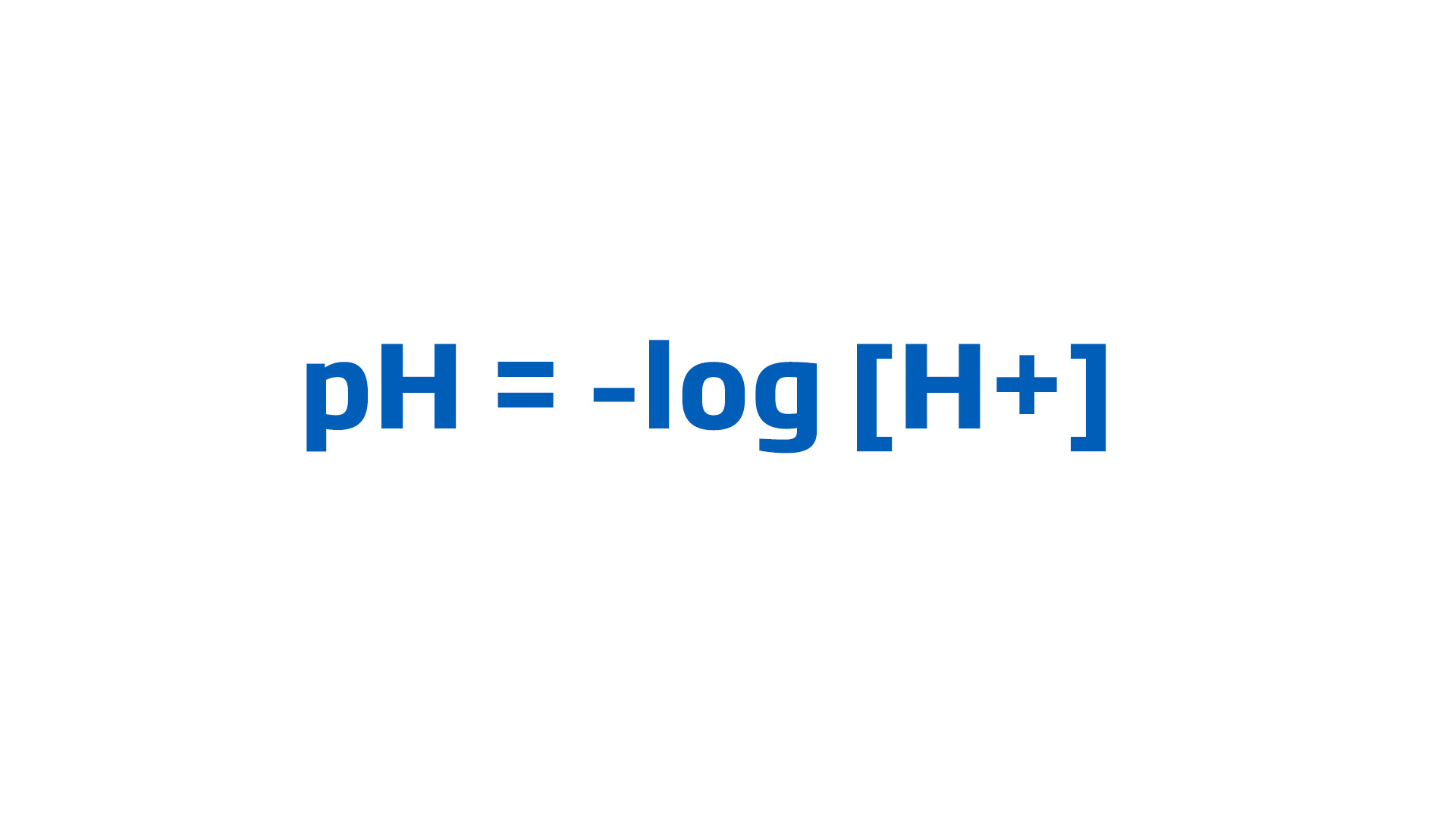
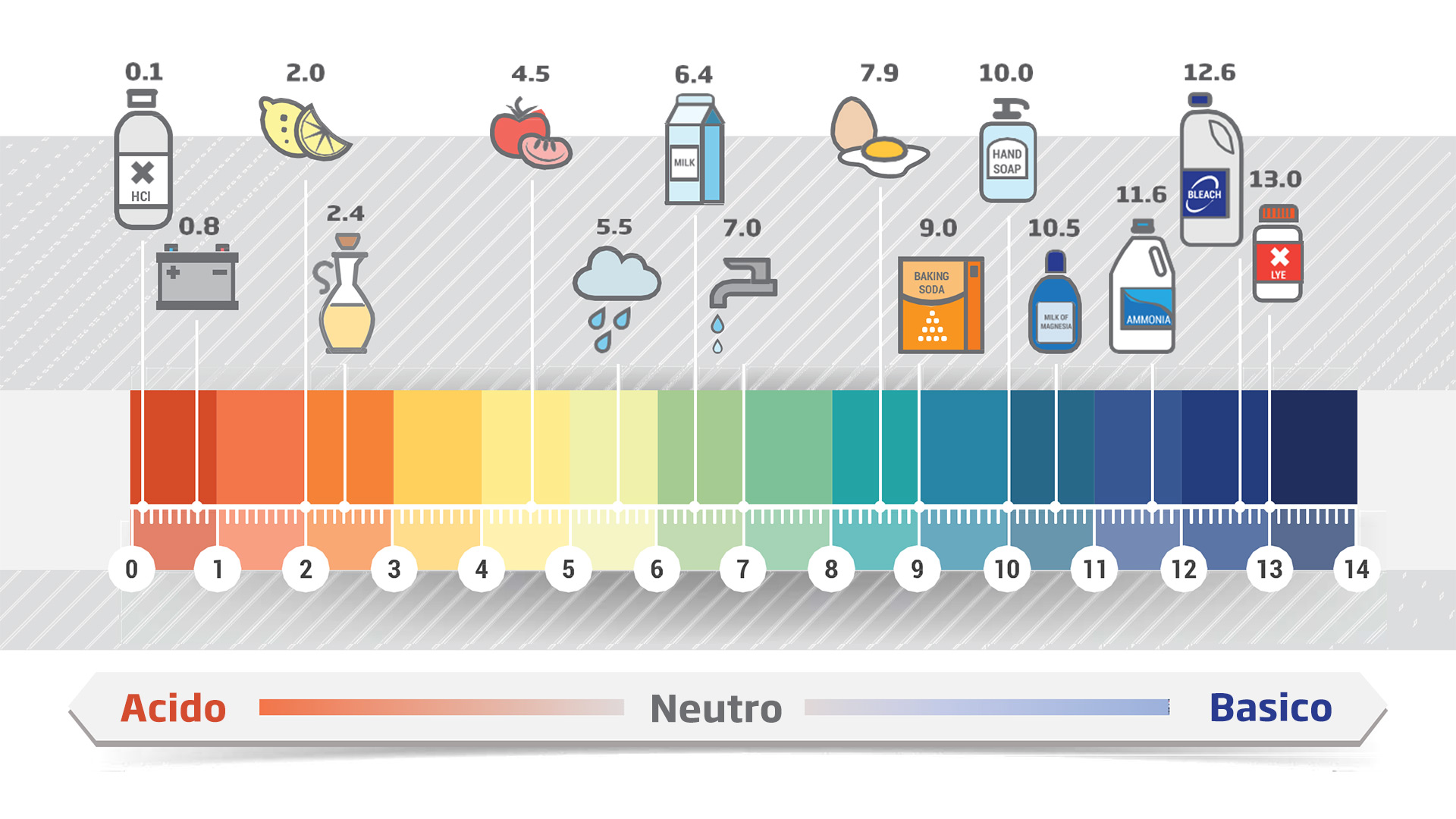
L’acidità di una soluzione dipende dalla concentrazione degli ioni H+ in essa contenuti e può variare di molti ordini di grandezza. In certe soluzioni supera 1 mol·L–1 (cioè 100 mol·L–1), in altre non raggiunge 10–14 mol·L–1.
Per comodità, l’acidità si esprime utilizzando l’esponente, cambiato di segno, della potenza del 10 che esprime la concentrazione degli ioni H+. Per esempio, nei due casi sopra descritti, l’acidità, ovvero il valore pH delle due soluzioni, sarebbe 0 e 14.
L’operazione matematica che consente di trasformare il numero 10–14 in 14 si chiama logaritmo decimale e si indica con log. Per tanto: –log 10–14 = 14.
Applicando questa definizione al caso del pH si ottiene:
pH = –log [H+]
dove [H+] indica la concentrazione degli ioni H+ espressa in mol·L–1
Si noti che il pH in chimica può assumere valori minori di zero e maggiori di 14.


Il pH di un campione varia in funzione della temperatura. Se la temperatura aumenta, aumenta anche l’attività ionica in quanto varia la dissociazione degli ioni in soluzione.
Per maggiore chiarezza Hanna riporta sulle etichette delle soluzioni standard di pH il valore corretto in funzione della temperatura.
Esempio: In caso di misurazione in acqua ultra pura, si osserva una variazione di ~1.3 pH tra 0 e 100°C. Questo esempio dimostra come anche una soluzione a pH neutro può essere influenzata dalla temperatura.
Le soluzioni tampone sono soluzioni stabilizzate e durante la calibrazione si visualizzerà il valore pH relativo a 25°C. Una volta terminata la calibrazione si leggerà il valore reale di pH alla temperatura di misurazione nella soluzione standard in quel momento.
Da questa equazione si può vedere se la temperatura T cambia. Anche il valore In(10)RT/nF noto come fattore slope cambierà. La tabella di seguito illustra come cambia la slope al variare della temperatura.
| Temperatura | Slope (mV/pH) |
|---|---|
| 05 | 55.18 |
| 10 | 56.18 |
| 15 | 57.18 |
| 20 | 58.17 |
| 25 | 59.16 |
| 30 | 60.15 |
| 35 | 61.14 |


Hanna Instruments offre strumentazione per la misura di uno o più parametri per soddisfare una varietà di analisi.
Strumenti a singolo parametro
Gli strumenti Hanna a singolo parametro sono semplici e accurati. Sono adatti a test dove il parametro di misura deve essere testato rapidamente e in modo diretto. Risultano sempre molto semplici da utilizzare anche da personale non tecnico.
Strumenti Multiparametro
Il vantaggio degli strumenti multiparametro Hanna è che l’operatore scegliendo un solo strumento ha la possibilità di misurare più parametri, anche simultaneamente. Gli strumenti multiparametrici offrono diverse modalità operative, riuscendo a soddisfare molteplici richieste.
Sono disponibili in due configurazioni:


Il pH ha un ruolo fondamentale nell’ambiente, influenzando un vasto ambito di processi vitali.
Ad esempio, il pH dell’acqua può avere impatto su organismi acquatici e terrestri, l’acidificazione delle acque può comportare serie conseguenze agli organismi marini e ai pesci. L’alterazione del pH influenza anche i nutrienti per le piante, con conseguente impatto anche sulle diverse catene alimentari.
In sostanza, il corretto controllo del pH può aiutare a monitorare le alterazioni della biodiversità e dell’ecosistema.
I corretti valori di pH sono quindi importanti anche per l’essere umano sotto molti punti di vista.
Ad esempio, va ricordata l’importanza del controllo del pH dell’acqua del rubinetto così come non va dimenticata la rilevanza della misura del pH in tutte le sostanze a diretto contatto con l’essere umano: dalla pelle fino alla sicurezza degli alimenti.


Hanna Instruments è il maggiore produttore europeo di elettrodi e di strumentazione analitica scientifica. Hanna ha contribuito ad alimentare il settore degli elettrodi con la sua metodologia innovativa.
Gli elettrodi di pH Hanna sono prodotti in centri di produzione di ultima generazione. Nel 1981, Hanna ha sviluppato una sua formulazione di vetro sensibile al pH avvalendosi degli esperti dell’Istituto Sperimentale del vetro di Murano (Venezia). Da quel momento l’azienda produce a mano elettrodi pH in vetro unici e inimitabili. A differenza di altre aziende che hanno ridotto la loro offerta, Hanna ha continuato ad espandere e personalizzare la sua linea di elettrodi rendendola adatta ad una varietà di applicazioni specifiche.
Inoltre, ha sviluppato e abbinato una varietà di soluzioni di pulizia e conservazione che garantiscono un utilizzo dell’elettrodo al massimo delle sue prestazioni.
| Sostanza | pH | Sostanza | pH |
| Acido cloridrico 1 M | 0 | Saliva umana normale | 6,5 – 7,5 |
| Succo gastrico | 1,0 – 2,0 | Sangue | 7,40 - 7,45 |
| Coca Cola e succo di limone | 2,5 | Acqua di piscina regolare | 7,2 - 7,8 |
| Aceto | 2,9 | Acqua di mare | 7,7 – 8,3 |
| Succo di arancia | 3,7 | Bicarbonato di sodio | 8,5 - 9,0 |
| Birra | 4,5 | Saponi alcalini | 9,0 - 10,0 |
| Pioggia acida | 4,5 - 4,8 | Ammoniaca | 11,5 |
| Caffè | 5,0 | Varechina | 12,5 |
| Tè e pelle sana | 5,5 | Liscivia | 13,5 |
| Acqua deionizzata a 25°C | 5,5 - 6,0 | Idrossido di sodio 1 M | 14 |
| Acqua ossigenata | 6,2 | ||
| Latte ben conservato | 6,5 - 6,7 | ||
| Acqua distillata a 25°C | 7,0 | Fonte: Wikipedia | |
"*" indica i campi obbligatori